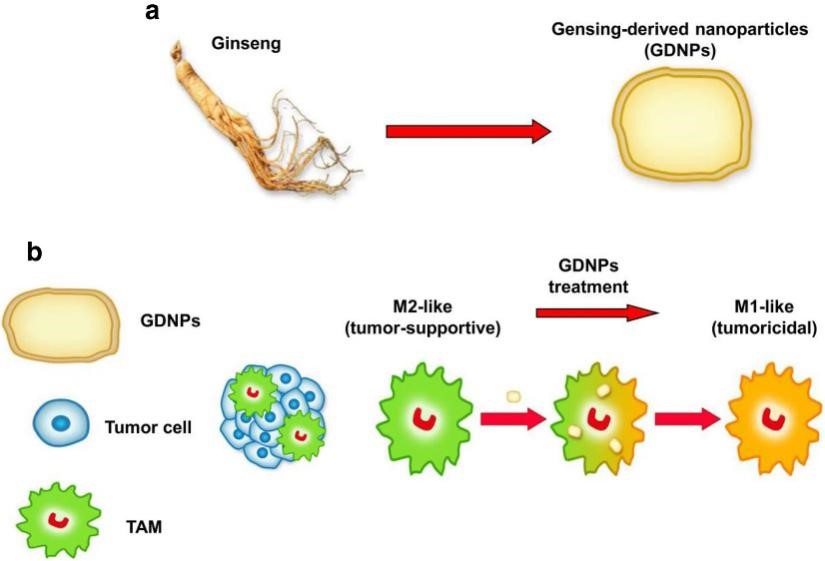
植物来源的细胞外囊泡是否介导哺乳动物细胞间的信号传导是未知的,肿瘤相关巨噬细胞在抑制肿瘤的M1型和促进肿瘤的M2型之间存在不同的极化状态,较低的M1/M2通常与肿瘤生长有关。
2019年11月,南京中医药大学曹鹏研究员团队于《Journal for ImmunoTherapy of Cancer》(IF= 8.676)在线发表论文“Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth”,旨在研究人参来源的细胞外囊泡是否可以调节M2型极化从而促进癌症的免疫治疗。结果发现,人参来源的细胞外囊泡 (GDNPs) 可有效促进M2至M1的极化,并产生活性氧,从而促进小鼠黑色素瘤细胞的凋亡。通过进一步研究发现GDNP诱导的M1型巨噬细胞极化主要依赖于Toll样受体-4和髓样分化因子MyD88介导的信号传导通路。GDNPs作为哺乳动物免疫反应过程的免疫调节剂可能成为癌症免疫疗法的新型纳米药物。中科新生命参与了脂质组学检测分析工作。
Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth
Journal for ImmunoTherapy of Cancer
实验材料:
野生型C57BL/6小鼠、MyD88-、TLR4-和TLR2-缺陷型C57/BL6小鼠
鼠黑色素瘤细胞系 (B16F10)、乳腺癌细胞系(4T1)和人胚胎肾细胞系(HEK293T)
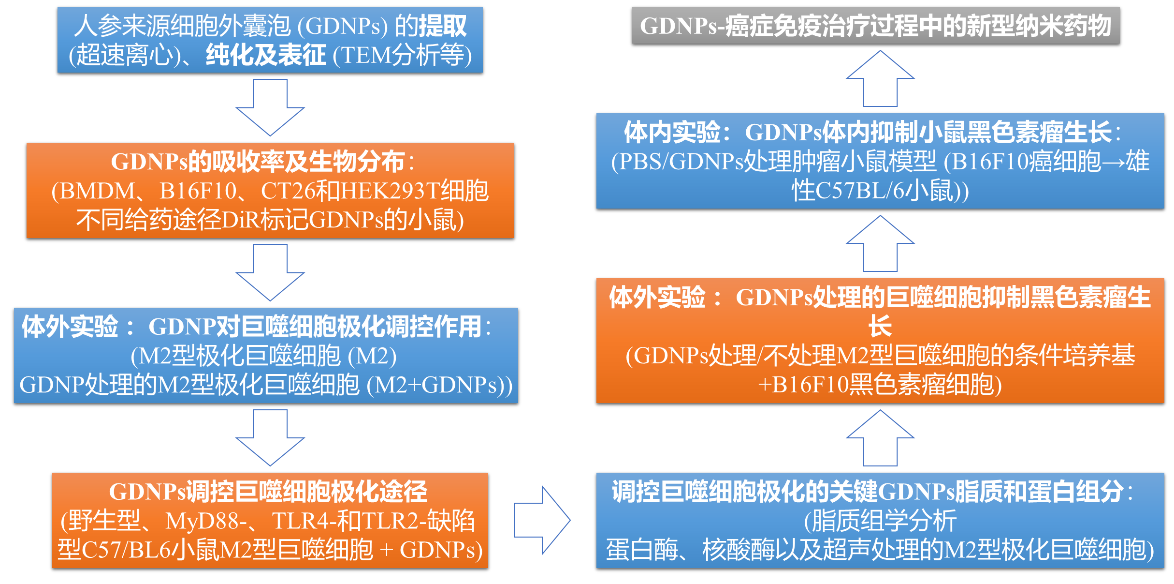
技术路线图:
研究结果:
1. GDNPs的分布、稳定性及生物相容性
通过比较BMDM、B16F10、4T1和HEK293T细胞对GDNPs的吸收率,发现BMDMs对GDNPs的吸收效率较高并且被吸收的GDNPs主要位于细胞质中。作者首先评价不同给药途径下标记GDNPs在生物体内的分布情况,结果发现腹腔注射以及静脉注射72 h后,大部分GDNPs位于肝脏和脾脏中;而灌胃后的GDNPs主要位于胃肠道中。连续跟踪体内GDNPs,发现给药7天后肝脏和脾脏中的GDNPs荧光信号仍然很强,这说明纳米粒子的大小和结构增加了GDNPs在生物体循环过程中的稳定性和保留能力。进一步通过FACS分析发现,注射的GDNPs很容易被巨噬细胞吸收 (13.7%),当CL存在时 (清除巨噬细胞),可观察到GDNPs的荧光信号在肝脏和脾脏中显著降低。上述结果表明GDNPs在体内和体外均具有向巨噬细胞的细胞趋向性。为了评估GDNPs在体外的生物相容性,对其进行细胞活力测定,结果发现,在给药范围内,GDNPs在体内和体外均无显著的毒副作用。
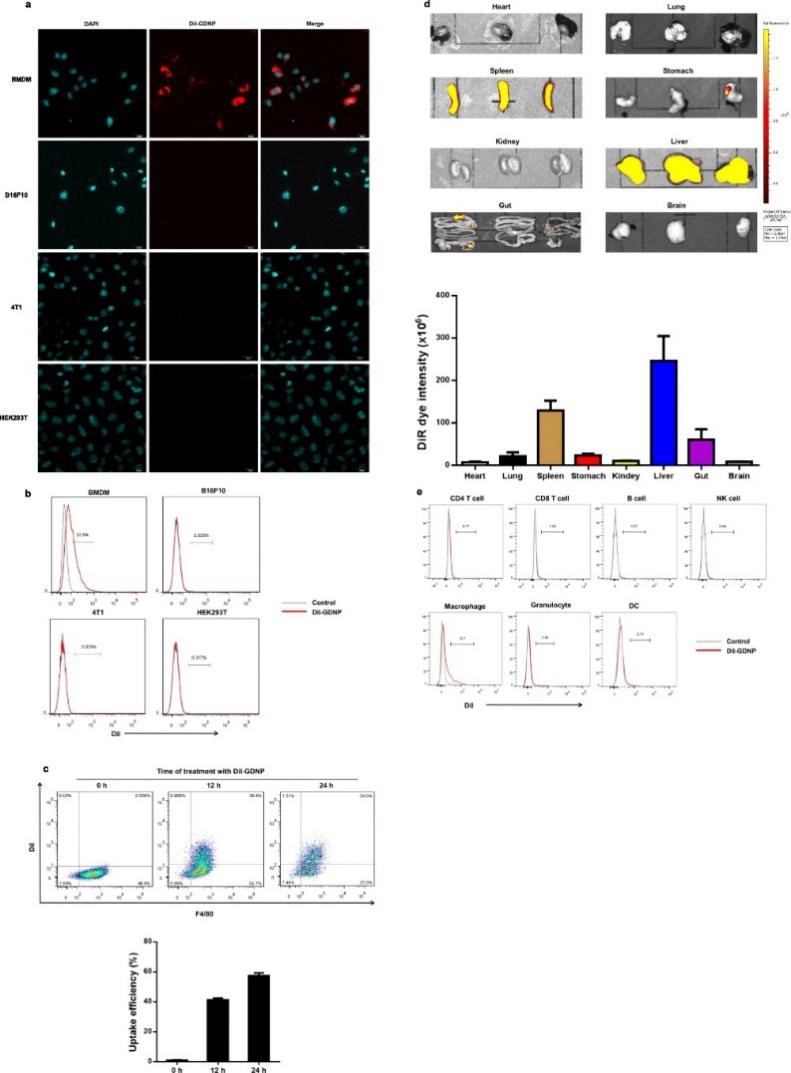
图1 巨噬细胞对GDNPs的吸收效率及评价
2. 体外实验:GDNPs改变巨噬细胞的M2型极化
M2型巨噬细胞占肿瘤相关巨噬细胞的绝大部分,因此,有效抑制或改变M2型细胞是癌症治疗的策略之一。因此,作者使用小鼠骨髓巨噬细胞加入IL-4和IL-13培养24 h使其转变为M2型细胞,随后加入GDNPs培养48 h,使用流式细胞仪对极化情况进行确证,结果发现GDNPs可显著降低M2型巨噬细胞中CD206含量,而使CD80、CD86、MHC-II和TLR2/4的表达水平显著上调。通过对M1和M2型巨噬细胞中M1-和M2-相关基因的定量分析发现,GDNPs可显著诱导M1相关基因而使M2相关的基因下调。同时,GDNPs可导致M1相关的细胞因子和趋化因子显著增加。上述结果表明GDNPs在体外可有效抑制巨噬细胞M2型极化。
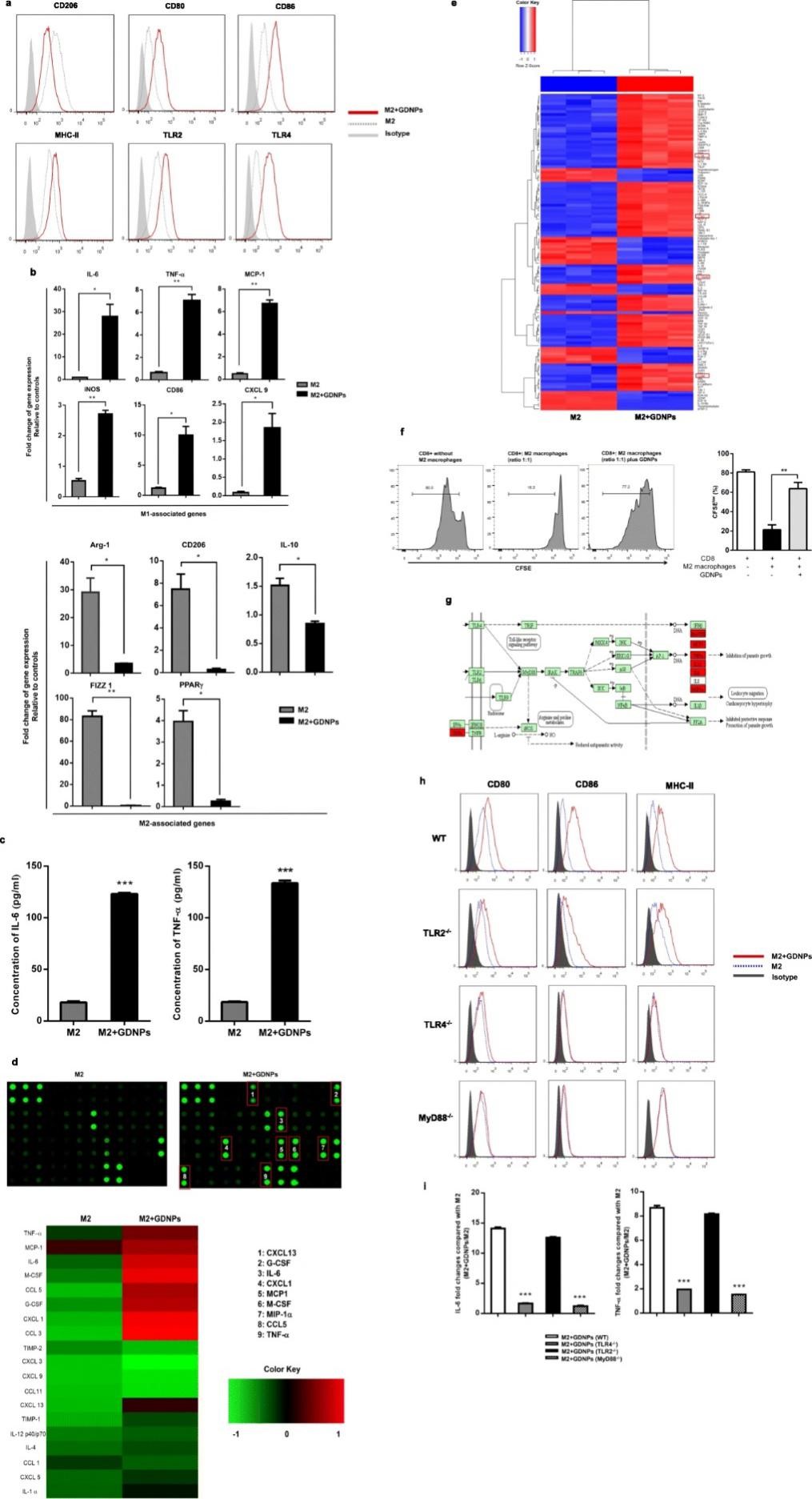
图2 GDNPs可抑制巨噬细胞M2型极化
3. GDNPs通过TLR4-和MyD88-途径调控巨噬细胞极化
鉴于GDNPs所引起巨噬细胞在免疫应答过程中的反应与病原体引起的TLRs/MyD88信号通路相似,因此推测GDNPs的免疫调节作用是通过相似的信号通路实现的。在MyD88缺失型鼠中获得M2型巨噬细胞,通过加入GDNPs培养48 h后发现M1相关的表面标志物及相关细胞因子IL-6/TNF-α并未发生上调。与上述实验过程类似,作者发现TLR2缺失型M2型巨噬细胞可以在GDNPs存在的条件下产生上述细胞因子,但无法在TLR4缺失型M2型巨噬细胞中产生,该结果表明TLR4可能与GDNPs的配体相互作用从而导致巨噬细胞极化。作者同时也分析了从非药用植物中提取的细胞外囊泡是否可发挥同样的作用,结果发现从黄瓜和猕猴桃中分离得到的EVs无法将巨噬细胞极化为M1型。
4. GDNPs处理的巨噬细胞在体外抑制黑色素瘤生长
为了研究GDNPs对巨噬细胞-肿瘤细胞相互作用的影响,分别使用/不使用GDNPs处理M2型巨噬细胞后置换培养基,过48 h收集上清液培养基作为条件培养基。使用上述条件培养基分别处理B16F10黑色素瘤细胞,结果发现与未被GDNPs刺激巨噬细胞条件培养基处理的黑色素瘤细胞相比,GDNPs刺激巨噬细胞条件培养基可显著增加黑色素瘤细胞凋亡。以往的研究报道指出总活性氧及超氧化物的含量在M1型巨噬细胞中上升,在本研究中,GDNPs处理的M2型巨噬细胞中总活性氧的含量高于未处理组,有助于M1型巨噬细胞的抗肿瘤功能。
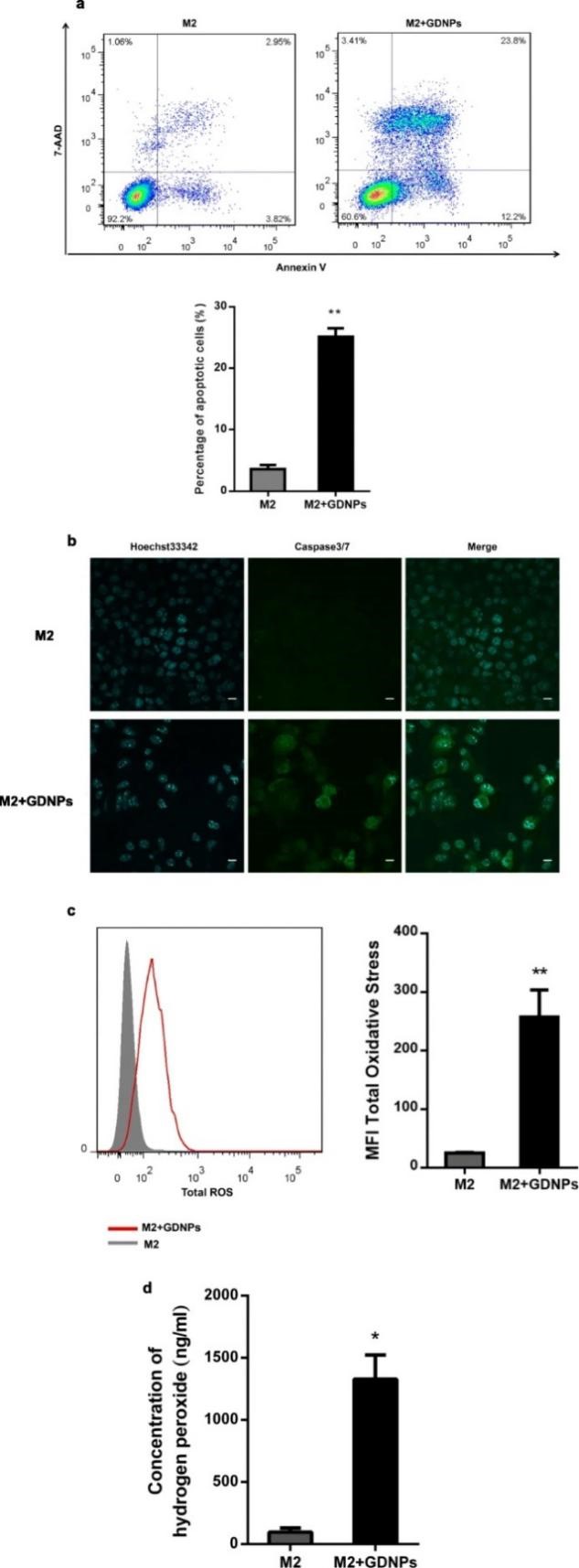
图3 GDNPs在体外抑制M2巨噬细胞促肿瘤细胞生长
5. GDNPs的脂质和蛋白改变巨噬细胞极化
为了探索GDNPs中调控巨噬细胞极化的关键组分,对GDNPs进行脂质组学的分析,结果发现GDNPs中二半乳糖单酰基丙三醇 (DGMG,59.4%)、溶血脑磷脂 (PE,16.8%) 和神经酰胺 (Cer,13.8%)含量较高。TLR4激动剂神经酰胺是重要的肿瘤抑制因子,在本研究中作者推测GDNPs的神经酰胺可能通过TLR4激活途径在巨噬细胞极化过程中扮演重要角色。当使用蛋白酶消化的GDNPs处理巨噬细胞时,可检测到少量的IL-6和TNF-α,说明GDNPs中的蛋白质对于其发挥抗肿瘤效果也是至关重要的。除此之外,超声处理的GDNPs可以导致M2型巨噬细胞M1相关的表面标志物以及IL-6和TNF-α显著下调,这说明GDNPs对于巨噬细胞极化是必须的。
为了进一步分析巨噬细胞吸收GDNPs的途径,作者研究发现LY294002可以显著抑制GDNPs吸收,而巨胞饮抑制剂EIPA对其摄入无显著影响,这说明巨胞饮并非巨噬细胞摄入GDNPs的主要途径。
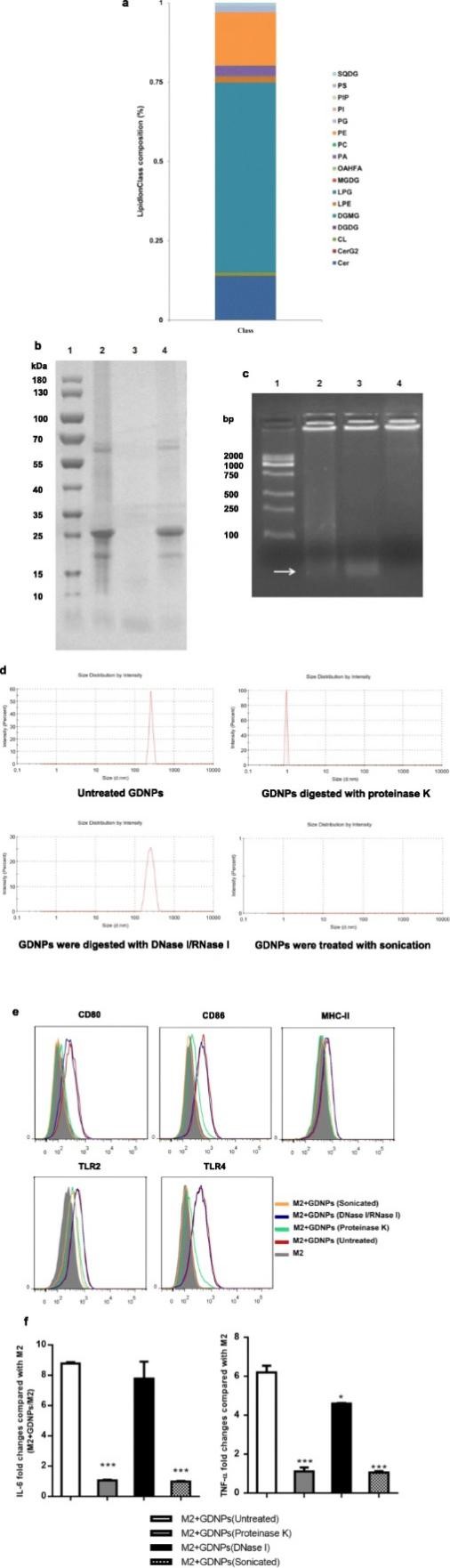
图4 与巨噬细胞极化过程相关的GDNPs组分分析
6. 体内实验:GDNPs体内抑制小鼠黑色素瘤生长
上述实验结果表明GDNPs在体外具有将M2型巨噬细胞极化等多种抗肿瘤的作用,为了验证在体内是否具有与体外同样的作用效果,作者建立肿瘤小鼠模型 (将B16F10癌细胞皮下接种到雄性C57BL/6小鼠),分别使用PBS或GDNPs处理,结果发现GDNPs可显著抑制肿瘤生长。与对照组相比,GDNPs处理组小鼠体内M1型细胞数量显著升高。通过对腹腔注射标记GDNPs跟踪发现,注射14天后,肿瘤微环境中大部分GDNPs被巨噬细胞摄入 (23.2%)。上述结果表明GDNPs可以在体内将M2型极化为M1型,使肿瘤微环境中的T细胞增加、肿瘤细胞死亡,从而抑制肿瘤生长。为了进一步验证GDNPs抑制肿瘤生长是否通过巨噬细胞发挥作用,作者通过比较GDNPs处理与GDNPs+氯膦酸盐脂质体 (清除肿瘤相关巨噬细胞) 处理的肿瘤小鼠模型发现,GDNPs+氯膦酸盐脂质体处理组小鼠无显著的肿瘤生长抑制作用,表明GDNPs是通过肿瘤相关巨噬细胞依赖型途径抑制肿瘤生长。
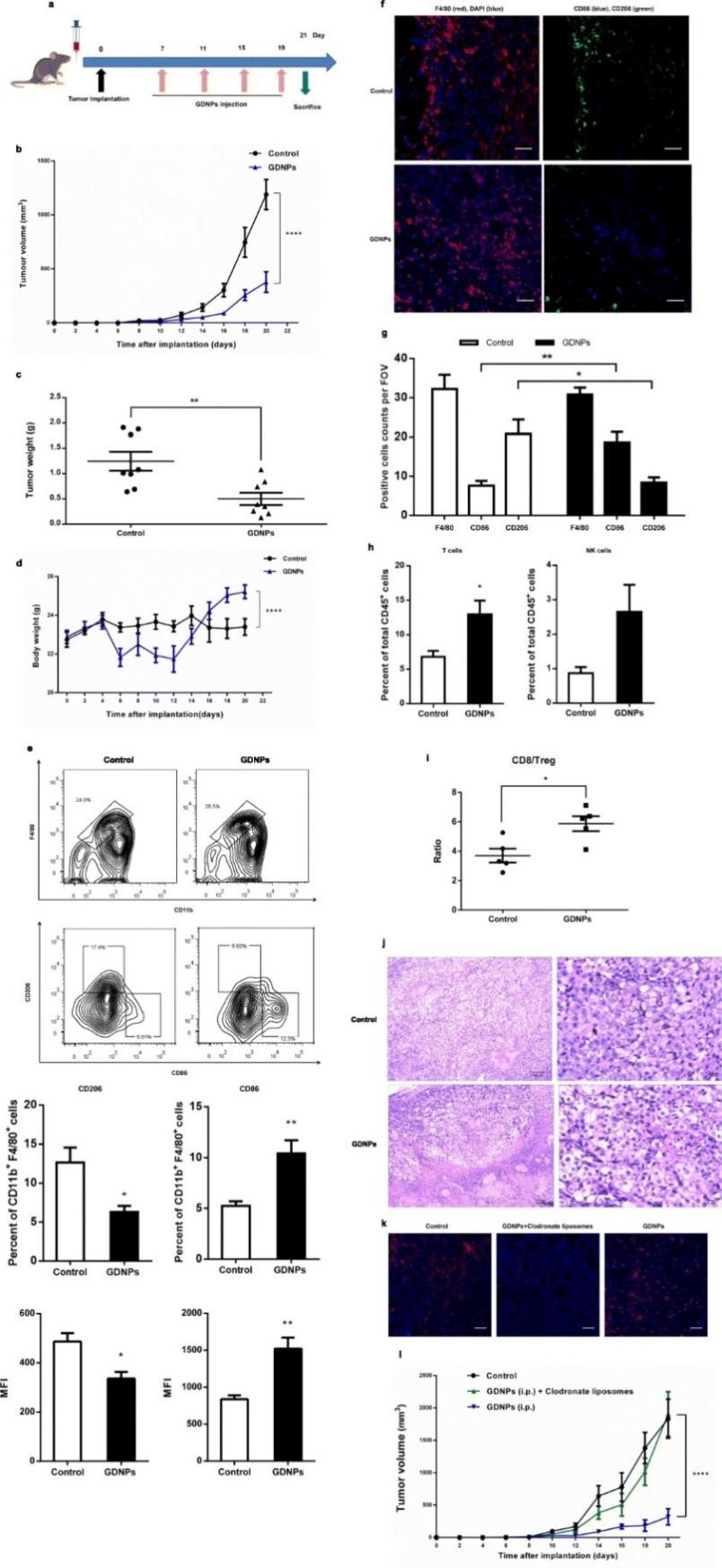
图5 GDNPs体内抑制黑色素瘤生长
小结:
该论文作者首次证实了GDNPs可以通过TLR4和MyD88信号途径在体内和体外改变M2型极化,从而实现抗肿瘤作用,因此,GDNPs可以作为哺乳动物免疫反应的免疫调节剂有望成为癌症免疫治疗过程中的新型纳米药物。
原文链接:https://jitc.biomedcentral.com/articles/10.1186/s40425-019-0817-4;IF


