
编者按
代谢性脂肪肝病(MAFLD)已成为当今最广泛的代谢性疾病之一,其主要诱因是肝脏过度脂质沉积和脂肪酸代谢过载引起的细胞氧化应激。AMP活化蛋白激酶(AMPK)是细胞能量代谢的关键感受器。在肝细胞中,AMPK的激活会反过来促进细胞内溶酶体相关的自噬进程,吞噬多余脂质,起到“一石二鸟”的作用,因此,溶酶体AMPK途径是增强MAFLD治疗效果的潜在靶标。
今天,我们分享2024年8月21日由安徽大学材料科学与工程学院毕红教授课题组在期刊 Advanced Functional Materials(IF=18.5)上发表的一项研究成果——“Two Birds with One Stone: Guanidyl Carbon Dots with Enhanced Antioxidative and Lipolytic Functions in Metabolic Associated Fatty Liver”,该研究利用斑马鱼MAFLD模型,基于药效团融合策略,设计开发了一种由二甲双胍和茶多酚反应合成的新型生物功能性碳点(MTCDs),该碳点表面保留了源自反应物的酚羟基和胍基,旨在减少肝脏中的脂质沉积和氧化应激。
进一步研究表明,采用MTCDs可保护溶酶体免受氧化应激损伤,并激活肝细胞AMPK信号,从而启动脂代谢和脂噬进程,加速脂肪分解和脂质消耗。因此,它可以作为一种有效的“一石二鸟”的MAFLD协同治疗工具,为多效药物的开发提供了一种新的策略。
文章题目
Two Birds with One Stone: Guanidyl Carbon Dots with Enhanced Antioxidative and Lipolytic Functions in Metabolic Associated Fatty Liver
杂志:Advanced Functional Materials(IF=18.5)
发表时间:2024年8月21日
作者:蔡皓、李子健副教授、毕红教授等
单位:安徽大学材料科学与工程学院
项目资助:由国家自然科学基金(52172033)和国家重点研发计划(批准号:2021YFA1600202)的资助;得到了安徽大学杂化材料结构与功能调控教育部重点实验室、安徽省绿色高分子材料重点实验室(安徽大学)的支持
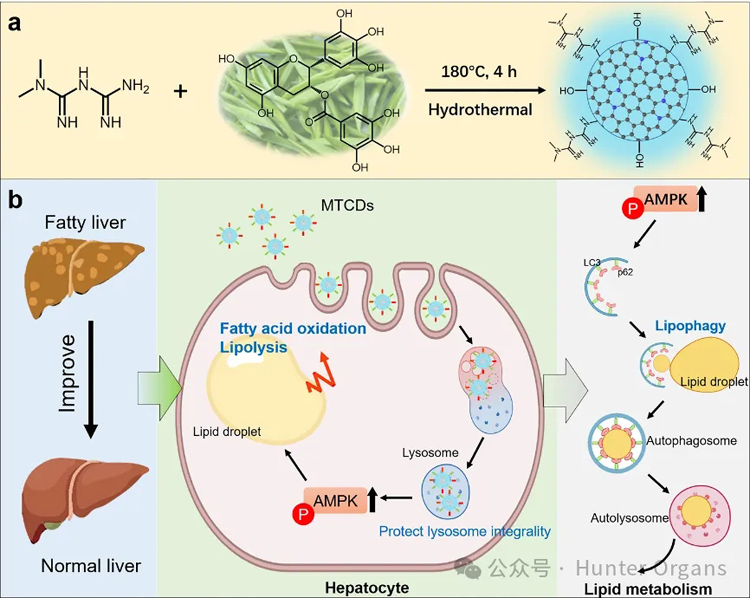
图1. MTCDs的(a)合成示意图及(b)其促进脂代谢、改善MAFLD的潜在机制
01、研究背景
代谢性脂肪肝病(MAFLD)已成为当今最广泛的代谢性疾病之一,其主要诱因是肝脏过度脂质沉积和脂肪酸代谢过载引起的细胞氧化应激。然而,由于目前的药物临床实验效果不理想,迄今为止,美国食品和药物管理局(FDA)或其他任何监管机构都没有批准针对MAFLD的特异性药物。
AMP活化蛋白激酶(AMPK)是细胞能量代谢的关键感受器,AMPK的活化能够加速细胞线粒体代谢、促进脂肪分解。值得注意的是,AMPK的激活需要溶酶体的参与,例如,一种经典的激动剂二甲双胍通过溶酶体PEN2蛋白来活化AMPK信号。在肝细胞中,AMPK的激活还会反过来促进细胞内溶酶体相关的自噬进程,吞噬多余脂质,起到“一石二鸟”的作用。因此,溶酶体AMPK途径是增强MAFLD治疗效果的潜在靶标。
本研究中,安徽大学材料科学与工程学院毕红教授团队以二甲双胍和茶多酚为前驱体,制备了表面富含胍基和酚羟基且具有溶酶体靶向功能的碳点纳米药物(命名为MTCDs),用以突破现有MAFLD治疗的瓶颈。其中,胍基用于激活肝细胞AMPK信号,促进脂代谢,而酚羟基则使得碳点具备抗氧化能力。通过改变前驱物的投料比,调节所制备的MTCDs的表面性质及zeta电位,使之可以大量富集在肝细胞的溶酶体中,保护溶酶体免收氧化应激损伤。
此外,研究人员在斑马鱼中建立了MAFLD模型,并与MTCDs样品共孵育,以研究MTCDs在体内的药理作用。实验结果表明,MTCDs通过激活溶酶体AMPK信号,一方面可以促进肝细胞脂代谢,另一方面可以促进溶酶体相关的脂噬作用,增强对MAFLD的治疗作用。
02、主要研究成果
1. MTCDs保留了前驱体亚甲基蓝和二甲双胍的部分功能基团(如酚羟基和胍基)
透射电镜图像(TEM,图2a)显示MTCDs粒子尺寸分布均匀,平均粒径为2.0 nm,碳核结晶性较好,其中晶面间距为典型的0.21 nm(图2a内插图)。原子力显微镜(AFM)测得MTCDs粒子的平均高度为2.3 nm(图2b),其X-射线粉末衍射(XRD)在22°处亦出现一个宽峰(图2c)。拉曼光谱在1415 cm−1(D带)和1611 cm−1(G带)信号的强度比为0.65(图2d)。
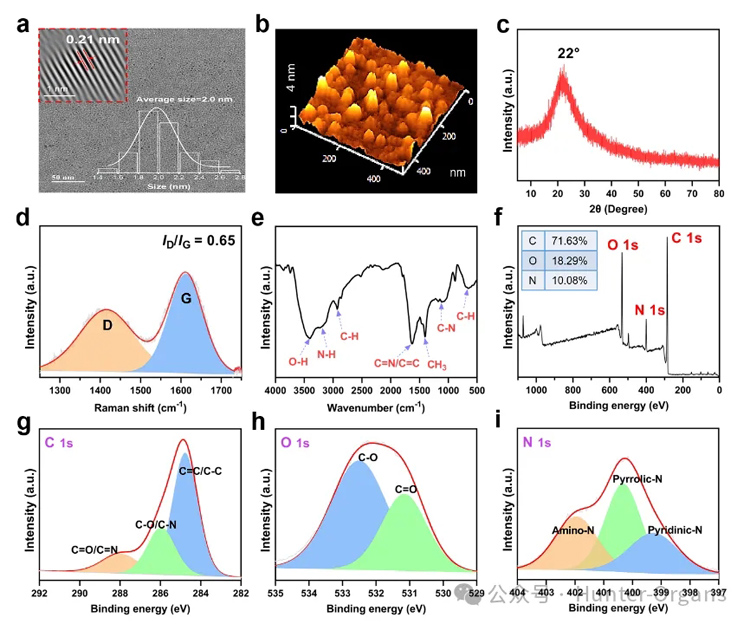
图2. MTCDs的(a)TEM图像,右插图为其尺寸分布,左上角插图为经过FFT处理后的碳核的高分辨TEM图像;(b) AFM图像;(c) XRD;(d)拉曼光谱;(e) FT-IR光谱;(f) XPS能谱以及(g) C1s;(h) O1s和(i) N1s高分辨XPS谱图。
红外光谱(FT-IR)显示有O−H (3400 cm−1)、C=N/C=C (1627 cm−1)和C−N (1125 cm−1)的振动峰(图2e),说明碳点表面可能存在胍基和酚羟基。X-射线光电子能谱(XPS,图2f)显示其中C、O和N元素的原子百分比分别为71.63 %、18.29 %和10.08 %,进而,高分辨C 1s XPS谱图(图2g)可分峰为C=C/C−C (284.78 eV)、C−O/C−N (285.95 eV)和C=O/C=N (288.10 eV),高分辨O 1s XPS谱图(图2h)可分峰为C−O (532.60 eV)和C=O (531.15 eV),高分辨N1s XPS谱图(图2i)可分成399.20 eV、400.35 eV和401.95 eV三个峰,分别归属为吡啶N、吡啶N和氨基N。
以上结果表明,反应产物MTCDs保留了前驱体亚甲基蓝和二甲双胍的部分功能基团(如酚羟基和胍基)。
2. 荧光共定位实验结果表明MTCDs可能大量富集在细胞溶酶体中
图3a紫外-可见吸收光谱显示MTCDs在水溶液中从紫外到可见光区均有吸收,其中在200-250 nm是碳点典型的紫外强吸收峰,一般认为是碳核态的π−π*跃迁所致,而在250-314 nm之间的紫外吸收与前驱体之一茶多酚的吸收峰位置相近,可归属于碳点表面酚羟基的n−π*跃迁,这说明前驱体的残留基团对MTCDs表面的发光中心有贡献。
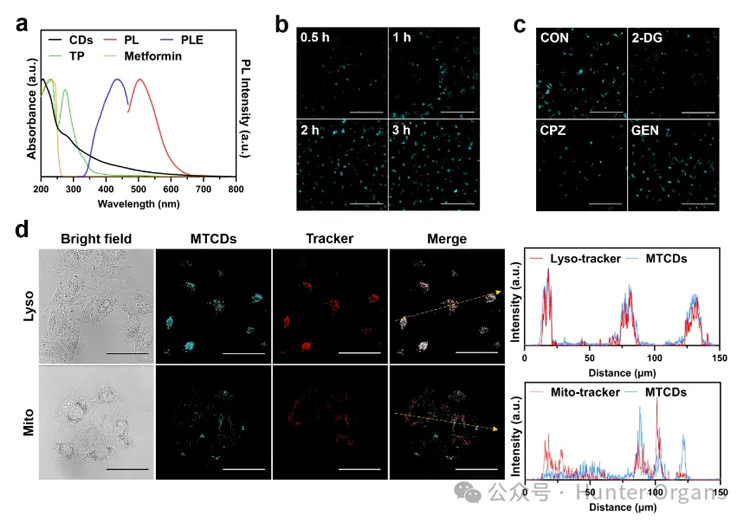
图3. (a) MTCDs在水溶液中的紫外-可见吸收、激发和荧光光谱。(b) HepG2细胞与MTCDs共孵育0.5 h,1 h,2 h和3 h后的CLSM图片,标尺= 50 μm。(c)不同内吞抑制剂(2-DG、CPZ、GEN)处理的HepG2细胞与MTCDs共孵育后的CLSM图片,标尺= 50 μm。(d)分别经 MTCDs、Lyso-tracker和Mito-tracker染色后的HepG2细胞CLSM图片及对应的荧光强度曲线,标尺= 50 μm。
此外,该碳点在314-600 nm光谱范围内仍然有一定程度的吸收,其在可见光区(400-600 nm)的吸收不可忽视。由图3a可见,在蓝光(激发波长为435 nm)激发下,MTCDs水溶液呈现青色荧光。进而借助于激光共聚焦显微镜(CLSM),观察到MTCDs可以在3小时内被肝细胞摄取(图3b)。
然而,当采用三磷酸腺苷合成抑制剂2-脱氧-d -葡萄糖(2-DG)或网格蛋白介导的内吞抑制剂氯丙嗪(CPZ)处理肝细胞,会抑制MTCDs被细胞摄取的进程,降低细胞的荧光强度(图3c),但小泡介导的内吞抑制剂染料木素(GEN)处理对肝细胞摄取MTCDs后的荧光强度没有影响(图3c),由此推论MTCDs的细胞内化途径主要是能量依赖型的内吞作用,且网格蛋白参与其中。
曾有文献报道网格蛋白介导的内吞作用促进了碳点在溶酶体中的定位,在本研究中,荧光共定位实验结果显示肝细胞经MTCDs染色的绿色荧光与商用溶酶体探针(Lyso-tracker)的红色荧光重叠良好(图3d),表明MTCDs可能大量富集在细胞溶酶体中。
3. MTCDs具有良好的ROS清除能力和降脂抗氧化功能
随后,作者对MTCDs的抗氧化降脂能力进行了研究。在肝细胞中用油酸和棕榈酸诱导了体外MAFLD模型。如图4a所示,与空白对照组相比,经油酸和棕榈酸处理后的肝细胞中ROS荧光探针的信号增强,但是加入MTCDs的组减弱了这种信号增强。
鉴于MTCDs在溶酶体中富集,作者还研究了MTCDs对过量氧化应激诱导的溶酶体损伤的保护作用。染料吖啶橙(AO)在溶酶体的酸性微环境中可以发出明亮的红色荧光,但受损的溶酶体完整性和酸度降低,因此红色荧光会减弱。作者发现油酸和棕榈酸处理降低了肝细胞的红色荧光强度,而与MTCDs或TP共孵育显著逆转了这种降低趋势(图4b),该结果表明MTCDs可以保护溶酶体免受这种氧化应激损伤。
此外,油酸和棕榈酸处理也增加了肝细胞中脂质过氧化标志物丙二醛(MDA)的表达,同时降低了抗氧化标志物超氧化物歧化酶(SOD)和谷胱甘肽(GSH)的表达。然而,MTCDs的加入逆转了这些改变(图4c-e)。
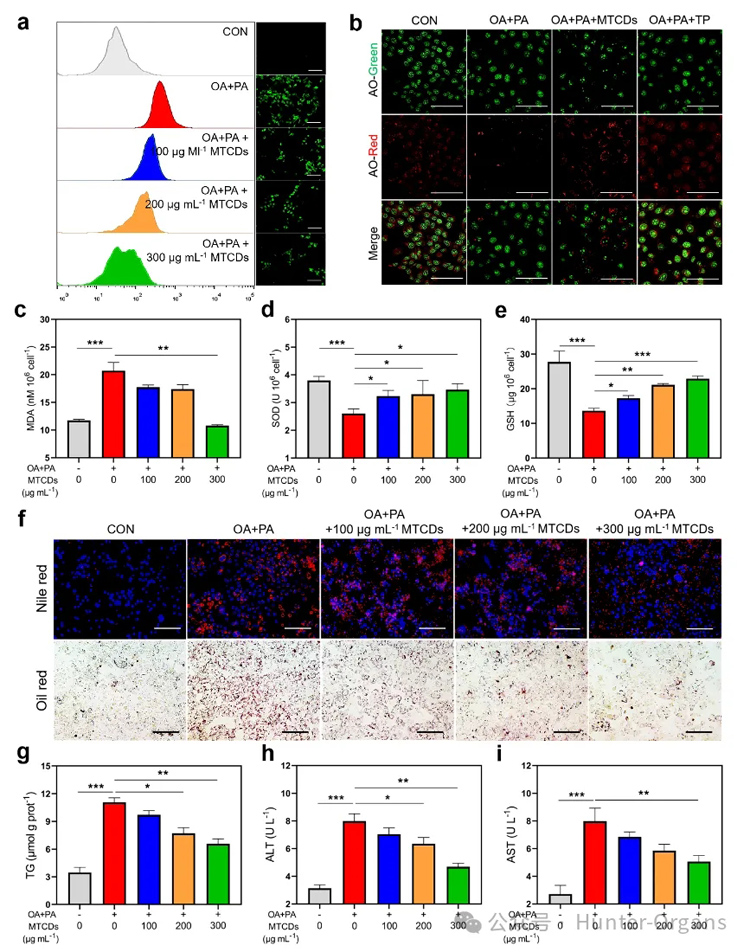
图4. (a) 经油酸、棕榈酸和不同浓度MTCDs分别处理后的HepG2细胞内ROS的荧光图像及相应的流式分析,标尺= 100 μm。(b) 经油酸、棕榈酸、MTCDs和TP处理后的HepG2细胞的AO染色(标尺= 50 μm)以及胞内(c) MDA、(d) SOD、(e) GSH的含量 (n = 6)。经油酸、棕榈酸和MTCDs分别处理后的HepG2细胞的(f)尼罗红、DAPI、Oil red O染色(标尺= 100 μm)、(g)总TG含量(n = 6)和(h, i)细胞培养液中ALT和AST的水平(n = 6)。数据以均数±SEM表示; * * p < 0.05, * * p < 0.01和* * * p < 0.001。
除了氧化应激外,过量的脂质沉积是MAFLD的另一个病理特征。如图4f所示,油酸和棕榈酸诱导组肝细胞的脂滴明显多于对照组,但加入MTCDs组减少了相应的脂质沉积,而且总甘油三酯(TG)的定量检测结果也显示出与脂滴染色相同的变化(图4g)。
此外,油酸和棕榈酸处理增加了培养基中肝损伤标志物丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)的含量,提示细胞膜受损(图4h和4i),但加入MTCDs组培养基中ALT和AST的含量降低(图4h和4i)。
上述结果表明,MTCDs具有良好的ROS清除能力和降脂抗氧化功能。
4. MTCDs对MAFLD的改善作用的潜在机制研究
研究人员进一步探讨了MTCDs对MAFLD的改善作用的潜在机制。如图5a,b所示,油酸和棕榈酸处理降低了AMPK催化亚基AMPKα1在肝细胞中的磷酸化水平,而加入MTCDs逆转了这种降低趋势,但使用AMPK抑制剂复合物C(简写为C.C)可以消除这种逆转作用,表明富集在溶酶体中的MTCDs在保护溶酶体功能的同时激活了AMPK信号,从而促进溶酶体相关的自噬,这是一种细胞防御和应激调节机制。
此外,P62和LC3作为自噬体的关键组成蛋白,分别与自噬通量呈负相关和正相关。如图5a, c和d所示,油酸和棕榈酸处理组的细胞与对照组相比,P62的表达更高,LC3Ⅰ/Ⅱ的比值更低,而加入MTCDs组逆转了这些变化,上述结果表明MTCDs可以通过AMPK介导的方式启动细胞自噬进程。
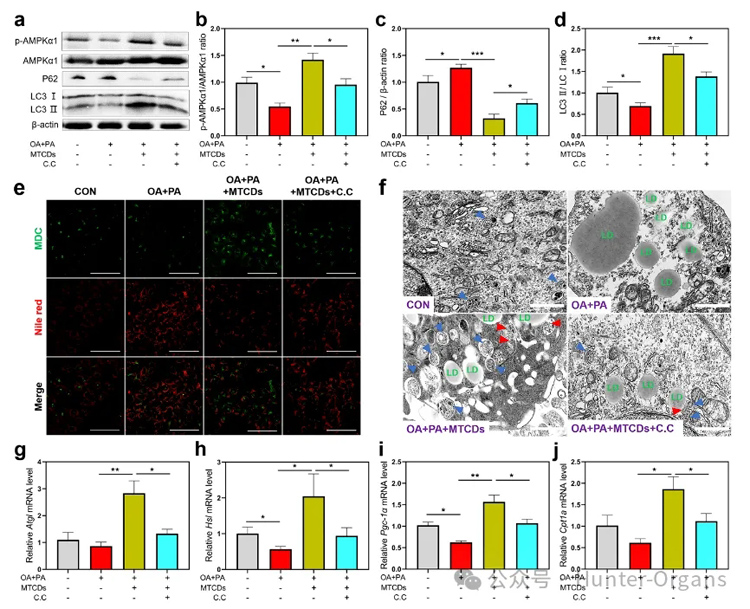
图5. HepG2细胞分别经油酸+棕榈酸、MTCDs和C.C处理之后,(a)细胞中P62、LC3Ⅰ/Ⅱ和AMPKα1磷酸化水平的免疫印迹,(b)磷酸化的AMPKα1与总AMPKα1, (c) P62与β-actin, (d) LC3Ⅱ与LC3Ⅰ的比值(n = 6)以及(e)尼罗红和MDC染色,标尺= 100 μm。(f) HepG2细胞电镜图像,标尺= 1 μm。(g) Atgl、(h) Hsl、(i) Pgc-1α、(j) Cpt1a 的mRNA相对表达量(n = 6)。数据以均数±SEM表示; * * p < 0.05, * * p < 0.01, 和* * * p < 0.001。
为了探究自噬与脂质减少之间的关系,作者研究了MTCDs诱导AMPK活化过程中的脂质吞噬,并采用丹酰尸胺(MDC)作为荧光探针来直观地反映荧光图像中的自噬水平。如图5e所示,油酸和棕榈酸处理增强了肝细胞中MDC的荧光强度,但降低了尼罗红的荧光强度,然而加入MTCDs组逆转了这些变化,该结果表明自噬水平与脂质沉积呈负相关。细胞电镜结果(图5f)也显示自噬体总量的变化趋势与MDC荧光成像结果相似。
值得注意的是,肝与MTCDs共孵育后,伴随着自噬体的增加,脂滴周围的自噬体数量也增加了(图5f中用红色箭头突出)。以上数据表明MTCDs会启动AMPK介导的脂质吞噬,消耗肝细胞中多余的脂质沉积。
最后,作者对脂代谢相关基因进行了监测,在油酸和棕榈酸处理的肝细胞中,随着脂噬的增加,MTCDs提高了脂肪分解(Atgl和Hsl)和脂肪酸氧化(Pgc-1α和Cpt1a)的基因表达(图5g-j),证明MTCDs通过激活AMPK信号通路促进肝细胞脂代谢。
5. 利用斑马鱼MAFLD模型来研究MTCDs在体内的药理作用
近年来,斑马鱼已成为体内脂肪肝研究的广泛而充分的模型,涵盖了生物医学、细胞生物学、生物材料等研究领域。在本研究中,研究人员在斑马鱼中建立了MAFLD模型,并与MTCDs样品共孵育,以研究MTCDs在体内的药理作用。
图6a荧光图像显示,MTCDs可以进入斑马鱼的胚胎,并在斑马鱼幼虫的肝脏、胃和肠道等代谢消化系统中富集。将5 dpf斑马鱼幼鱼在含有2 mg mL-1蛋黄粉和3%葡萄糖(w/v)的E3缓冲液(简称HF)中孵育2周作为对照组,与此同时,在HF缓冲液中加入不同浓度的MTCDs与斑马鱼共孵育作为实验组。如图6b-d所示, MTCDs逆转了HF饮食诱导的斑马鱼MDA增加的同时SOD和GSH减少的趋势,这与MTCDs在细胞中的抗氧化特性相一致。
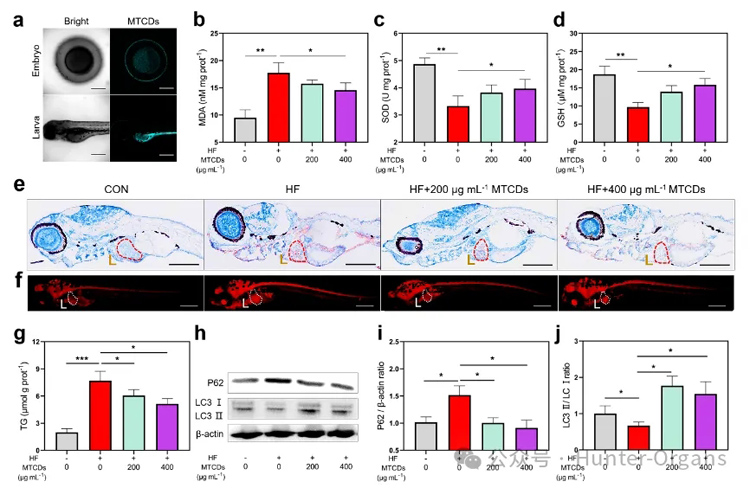
图6. (a) MTCDs孵育组的斑马鱼胚胎和幼虫的CLSM,标尺= 100 μm。用蛋黄粉和葡萄糖饲喂斑马鱼幼鱼2周,在此期间添加了不同剂量的MTCDs,测得斑马鱼中(b)丙二醛(MDA)、(c)超氧化物歧化酶(SOD)和(d) GSH浓度(n=30)。(e)斑马鱼幼鱼经苏木精和油红O染色,肝脏用红色虚线突出,标尺= 100 μm。(f)斑马鱼幼鱼尼罗红染色,肝脏以白色虚线突出显示,标尺= 100 μm。(g)斑马鱼幼鱼总TG含量(n = 30)。(h)斑马鱼幼体P62和LC3Ⅰ/Ⅱ免疫印迹。(i) P62与β-actin和(j) LC3Ⅱ与LC3Ⅰ的比值(n = 8)。数据以均数±SEM、Mann-Whitney检验的单因素方差分析表示;* * p < 0.05, * * p < 0.01, 和* * * p < 0.001。
此外,油红O和尼罗河红染色结果(图6e和6f)显示,尽管HF饮食诱导了肝脏中过量的脂质沉积,但加入200 mg mL-1和400 mg mL-1 MTCDs组均改善了斑马鱼的脂质积累。同样,斑马鱼幼鱼总甘油三酯(TG)含量的定量检测结果显示脂质沉积的变化趋势与脂质染色的相似(图6g)。
由于自噬蛋白高度保守,作者还检测了P62和LC3在斑马鱼肝脏中的表达。如图6h-j所示,研究结果表明MTCDs降低了HF饮食诱导斑马鱼的P62表达,增加了LC3Ⅰ/Ⅱ的比值,提示其肝脏的自噬通量和脂噬增强。
总的来说,以上数据表明MTCDs通过AMPK信号通路促进了脂质代谢,从而改善HF饮食诱导的MAFLD。
03、编者点评
综上所述,本研究基于药效团融合策略,设计开发了一种由二甲双胍和茶多酚反应合成的新型生物功能性碳点(MTCDs)。该碳点表面保留了源自反应物的酚羟基和胍基,旨在减少肝脏中的脂质沉积和氧化应激。此外,通过对表面电荷的精细控制,MTCDs具有良好的溶酶体靶向功能和生物相容性,而且生物毒性很低。进一步研究表明,采用MTCDs可保护溶酶体免受氧化应激损伤,并激活肝细胞AMPK信号,从而启动脂代谢和脂噬进程,加速脂肪分解和脂质消耗。
总的来说,这项工作提出了一种有效的“一石二鸟”的MAFLD协同治疗工具,并为多效药物的开发提供了一种新的策略。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
