近年来随着代谢组学的应用,肿瘤中代谢重编程现象得到了更细致的描绘。大量研究已经指出肿瘤细胞依赖于独特的代谢需求来维持增殖和诱导转移,这种代谢异质性在一定程度上是肿瘤发生和存续的基础[1],通过全面描绘代谢表型与通路流动变化,发现肿瘤代谢关键节点来揭示肿瘤形成机制与发现新治疗策略已经被证明是可靠和高效的研究模式。 英国Glasgow大学的癌症研究所的Hing Y. Leung等人在Nature Comunnication(IF=14.9)发表了题为“2,4-dienoyl-CoA reductase regulates lipid homeostasis in treatment-resistant prostate cancer”的论文。研究者对三种AR inhibitors(ARI)产生抗药性的肿瘤细胞,通过全谱代谢组和代谢流进行全面描绘ARI抵抗肿瘤细胞中发生的代谢异质性,发现与代谢改变有关的蛋白DECR1,并对其在ARI抵抗中发挥的功能与调控机制进行了研究和验证,为治疗去势抵抗性前列腺癌提供了一个潜在的治疗靶点。 图1 ARI抵抗的肿瘤细胞表型改变 研究使用bicalutamide,apalutamide和enzalutamide三种ARI培养肿瘤细胞使产生ARI抵抗性。观察发现,ARI抵抗细胞出现形状增大和增殖速度减缓,交叉使用不同ARI后发现ARI抵抗具有一定共通性。对三种抗药性及亲本细胞检测发现AR 的蛋白和mRNA表达水平及蛋白表达定位未产生明显变化。而下游两个典型蛋白KLK3在ARI抵抗细胞中显著降低和FKBP5表达情况未产生变化。这说明肿瘤细胞的生存策略可能是内部重编程来应对ARI的作用,而不是使药物靶点失活。 图2 ARI抵抗细胞中代谢通路的蛋白及代谢物发生明显变化 2. 蛋白组发现线粒体中代谢相关蛋白显著上调 研究使用3D基质培养亲本和三种ARI抵抗性细胞,形成立体肿瘤结构,并进行蛋白组分析。通过通路富集分析发现相比亲本细胞,ARI抵抗性细胞中绝大部分涉及代谢通路的蛋白均出现上调。通过对相关蛋白进行定位,发现上调蛋白集中表达于线粒体内。另外发现代谢合成与脂肪酸相关的两种细胞因子PPARG和PGC1a也出现上调。线粒体是细胞内糖脂代谢转运的关键节点,可能暗示ARI抵抗性细胞内发生代谢重编程。 3. 全谱代谢组与代谢流描绘代谢重编程表型 研究者使用全谱代谢组对ARI抵抗性细胞中的各种代谢物表达水平进行检测,发现ARI抵抗性细胞内葡萄糖含量较低,但糖酵解通路上相关代谢物,诸如H6P, G3P, DHAP等却高水平积累。 通过代谢流技术检测相关代谢通路流向变化,使用[U13C]-glucose标记ARI抵抗细胞,标记四种细胞1h后,糖酵解途径流量变大,产生乳酸和丙酮酸,而丙酮酸最终会进入线粒体生成乙酰辅酶A大量合成脂质,这是侵袭性前列腺癌的重要特征。研究者继续使用[U13C]-glucose标记耐药细胞72h,检测相关中长链脂肪酸表达情况。发现AIR抵抗细胞中被13C标记的棕榈酸、油酸和硬脂酸积累水平显著上升。这说明ARI抗性细胞中葡萄糖消耗最终会导致脂肪酸的大量合成。 对细胞中的脂质进行分析,在ARI抵抗细胞中大部分脂质出现显著上调,三个ARI抵抗细胞系都显示出甘油三酯的积累,另外多种神经酰胺和心磷脂衍生物在耐药细胞系表达水平也更高。这些结果清楚的描绘了ARI抵抗细胞中代谢重编程的现象,推测ARI抵抗性可能会与脂肪酸代谢相关蛋白有关。 图3 ARI抵抗细胞中脂质积累变化 4. DECR1介导的代谢重编程机制与功能研究 研究通过构建AR基因敲除模型的方式证明了ARI抵抗细胞中的代谢重编程现象与ARI抗性有关。对蛋白组数据进行分析,比较三种ARI抵抗和亲本细胞中的蛋白变化,排除不同的ARI作用与培养条件因素的影响,最终确认13个对ARI抵抗有调节作用的蛋白。其中线粒体2,4-dienoyl-CoA还原酶DECR1是一种参与不饱和脂肪酸代谢的辅助酶,结合代谢表型结论,可能与ARI抵抗有关联。在后续的验证中,DECR1瞬时沉默可以增强ARI作用效果,减缓肿瘤增殖速度,而过表达DECR1会导致肿瘤细胞增殖速度略微上升,证明DECR1对ARI抗性有调控作用。尽管有报道称AR可以直接调控DECR1但是研究者在验证中并没有发现明显证据,所以DECR1的具体作用机制还需要进一步研究。 图5 CDER1与ARI抗性关联明显 比较不同细胞系CRPC状态下,ARI处理后的CDER1表达水平均发生明显上升。在临床样本中比较产生ARI抵抗前后患者的组织样本,发现产生ARI抵抗情况后,组织中CDER1表达水平明显出现上升,另外在小鼠模型中也有同样的发现。对癌症基因组图谱(TCGA)进行分析,发现CDER1与肿瘤转移密切相关而且与患者较差预后治疗密切相关。有成为诊断Biomarker的潜力,进一步通过敲除CDER1发现细胞内不饱和脂肪酸出现上调,这可能与脂质稳态受损有关,会导致细胞脂质过氧化和铁死亡。对脂质稳态受损的相关标志蛋白进行检测验证,发现脂质解毒酶谷胱甘肽过氧化物酶4(GXP4)表达上调明显。后续使用GXP4抑制剂处理CDER1敲除细胞与对照组,CDER1敲除细胞表现更敏感,而通过外源添加铁死亡抑制剂可以恢复CDER1敲除细胞的形态和功能。将敲除CDER1的肿瘤细胞原位注射回小鼠体内,肿瘤大小缩小近41%,并且肿瘤高度坏死。 小结 研究者通过蛋白组+全谱代谢组+代谢流对抗药性肿瘤细胞进行全面的代谢表型和通路流向描绘,并最终锁定涉及ARI抵抗性调控的关键蛋白DECR1,对其调控机制进行了研究和验证,证明了DECR1作为治疗靶点的潜力。 [1]Seyfried T N , Shelton L M . Cancer as ametabolic disease[J]. Nutrition & Metabolism, 2010, 7(1):7-7. 中科优品推荐 中科新生命提供4D蛋白组+全谱非靶代谢组+代谢流的全套研究产品,欢迎公众号留言或拨打热线电话(021-53662463)咨询。

研究内容
1. ARI抵抗细胞表型改变与代谢变化有关
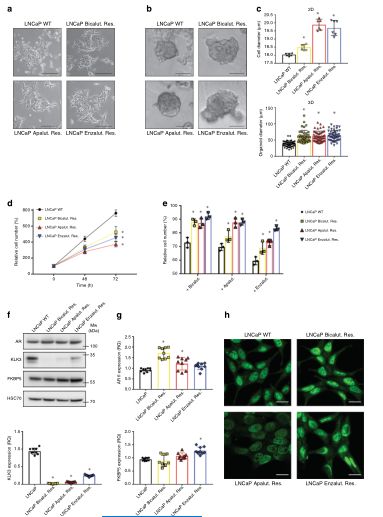
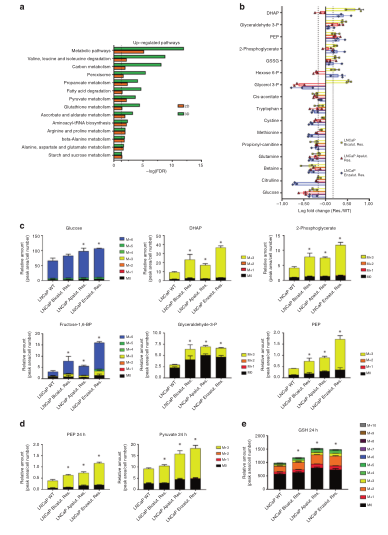
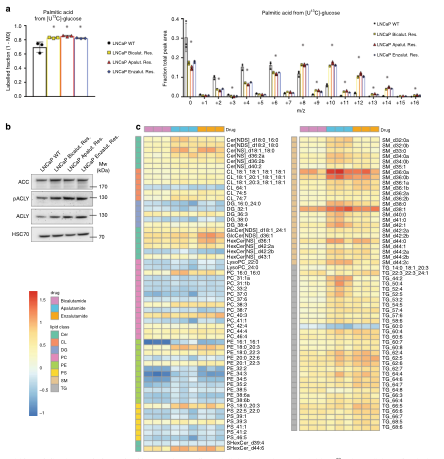
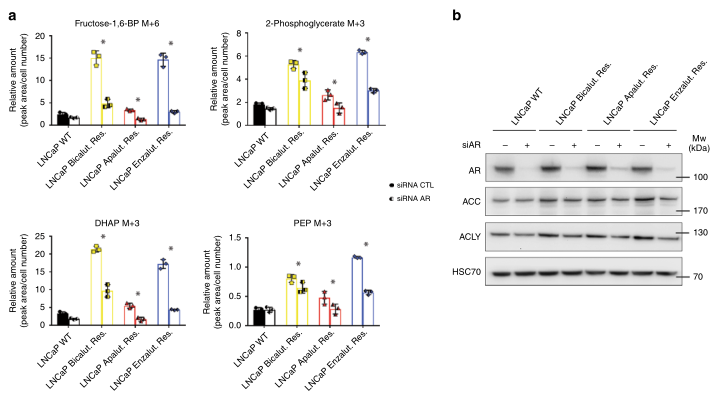
图4 代谢重编程与ARI抗性有关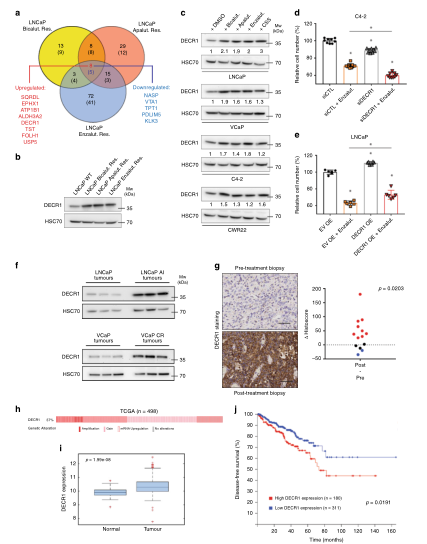
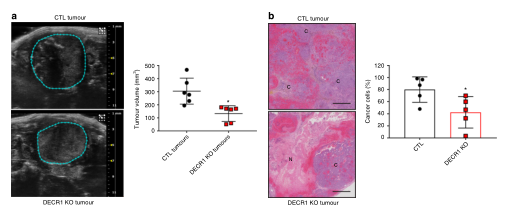
图6 CDER1敲除肿瘤在小鼠体内体积明显缩小
Nat Commun | 从代谢表型出发挖掘ARI抵抗肿瘤耐药调控靶点
作者:上海中科新生命生物科技有限公司 2021-12-27T18:57 (访问量:2337)
上海中科新生命生物科技有限公司 商家主页
地 址: 上海市园美路58号1号楼15-18楼
联系人: 徐
电 话: 021-54665263
传 真:
Email:marketing@aptbiotech.com
相关咨询
会议邀请 | 第8届全国植物蛋白质研究大会暨首届贵阳生命科学新高地科学家论坛 (2023-07-07T14:37 浏览数:18850)
项目文章Cell(IF 64.5)| 中国科技大学探索食物过敏谜团 (2023-07-07T14:22 浏览数:19281)
Gastroenterology(IF 29.4)| 基于机器学习算法开发的外泌体miRNA生物标志物用于胰腺导管腺癌早期诊断 (2023-07-05T15:54 浏览数:17017)
Cancer Letters(IF 9.7)|天津市环湖医院利用Labelfree揭示超声-替莫唑胺联合诱导胶质瘤细胞的凋亡机制 (2023-06-30T09:37 浏览数:17958)
Excel表免费下载 | 速来围观!2023年影响因子发布 (2023-06-29T09:35 浏览数:15361)
外泌体多组学创新解决方案,精准、前沿的疾病诊断生物标志物 (2023-06-28T10:20 浏览数:21626)
Immunity (IF=43.474)丨单细胞+空间联合揭示肉芽肿形成的异常淋巴发育进程 (2023-06-26T17:28 浏览数:17090)
专家齐聚 亮点回顾 | 2023年海口·中医药创新多组学研究论坛圆满落幕 (2023-06-25T10:10 浏览数:21631)
项目文章Plant J(IF 7)| 杭州师范大学王慧中团队通过空间代谢+单细胞测序等揭示红豆杉幼茎细胞特异的紫杉烷合成调控模式 (2023-06-25T09:42 浏览数:19231)
项目文章Gut Microbes(IF 9.434)| 肠道微生物竟是导致胆囊切除术后患者腹泻的元凶? (2023-06-14T16:35 浏览数:16509)
